Aquariophilie - Chimie des solutions
L’aquariophilie ou « passion du monde aquatique » , une activité passionnante qui permet d’élever de fabuleuses espèces de poissons chez soi. Cependant, beaucoup d’entre nous désenchantent vite…surtout en eau chaude avec les poissons tropicaux. En effet, l’étude de l’eau contenant ces poissons requière la connaissance et la maitrise de deux paramètres chimiques comme le pH ou le titre hydrotimétrique aussi appelé « dureté de l’eau ».
L’aquariophilie est tout un monde ! Nous allons donc voir dans cet article la partie chimique de l’aquariophilie.
Que contient un aquarium ?
Un aquarium est avant tout un gros volume d’eau et en chimie plus il y a d’eau plus c’est facile ! En effet, un aquarium de 500L est plus facile a stabilisé qu’un aquarium de 50L. Cela est dû au pouvoir tampon des ions contenus dans l’eau.
Voyons d’abord les deux paramètres sur lesquels vous allez pouvoir agir dans un aquarium.
La partie suivante de l’article nécessite des notions de chimie abordées en Terminale scientifique .
Notions abordées :
![]() Domaine de prédominance
Domaine de prédominance
![]() Echelle des pH
Echelle des pH
![]() Utilisation du logarithme décimale
Utilisation du logarithme décimale
![]() Couple acide/base
Couple acide/base
Le titre hydrotimétrique ou dureté de l’eau.
Le pur chimiste utilise le terme « titre hydrotimétrique » pour la dureté de l’eau. La dureté fait référence aux ions carbonate ou hydrogénocarbonate qui sont souvent liés au calcium (Ca2+) ou au magnésium (Mg2+). La dureté carbonatée concerne la quantité de carbonate et d’hydrogénocarbonate qui peut être éliminée ou précipitée par ébullition. Ce type de dureté est responsable de l’entartrage des canalisations d’eau chaude et des bouilloires. La dureté non carbonatée est due à l’association des cations responsables de la dureté avec les sulfates, les chlorures et les nitrates. On l’appelle également « dureté permanente », car elle ne peut être éliminée par ébullition. Cependant, la dureté non carbonatée n’influence guère la vie des poissons. Nous n’en parlerons pas ici.
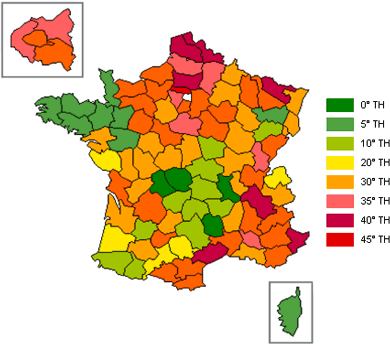
On trouve différents noms pour la dureté : en allemand GesamtHärte (°GH), en américain Total Hardness (°TH) et °f en Français. Selon le pays, le degré ne mesure pas la quantité des mêmes ions. Le GH est très souvent utilisé en aquariophilie. Cependant nous utilisons de l’eau Française renseignée en titre Français… Pas le choix, il faut jongler entre les deux !
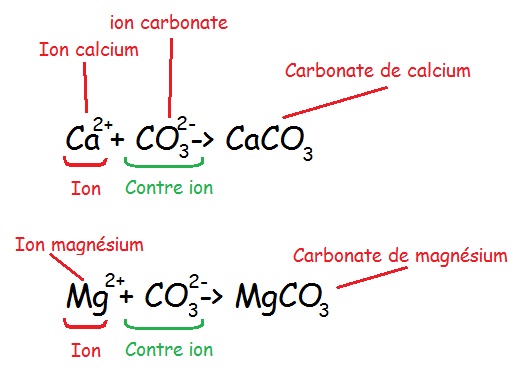
En France, on mesure la concentration en carbonate de calcium donc du calcaire.
1 degré Français correspond à 4 mg de Calcium par litre d’eau ou 2 mg de Magnésium par litre d’eau.
De 0 à 7° l’eau est très douce, de 7° à 15° elle est douce, de 15° à 25° moyennement dure, de 25° à 42° elle est dure et enfin >42° elle est très dure.
Il existe des cartes de la dureté de l’eau du robinet Française par région.
Cependant, je vous recommande de ne pas utiliser seulement l’eau du robinet pour votre aquarium car elle contient trop souvent des quantités énormes de chlore, nocif pour les poissons. En animalerie, ils peuvent vous vendre de l’eau osmosée (quasiment pure), parfaite pour l’aquariophilie, il suffit alors d’y ajouter les bonnes solutions tampons. Mais nous y reviendrons.
Le pH
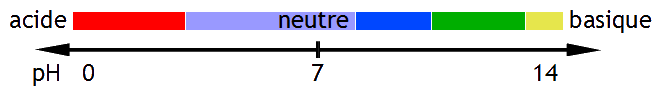
Le pH est une échelle allant de 1 à 14. On dit qu’une solution est acide lorsque le pH est compris entre 1 et 6, neutre quand pH=7 et basique si le pH est compris entre 8 et 14.
Quelques
exemples :
![]() Soude caustique : pH=14
Soude caustique : pH=14
![]() Acide Chlorhydrique : pH=1
Acide Chlorhydrique : pH=1
![]() Eau distillée : pH environ de 7.
Eau distillée : pH environ de 7.
(Pour les experts : pour un acide fort du type HCl, H2SO4, HNO3, le pH se calcule avec la formule suivante, pH=-log[H3O+]. Le pH est donc l’opposé du logarithme décimal de la concentration en ions hydronium qui sont les ions responsables de l’acidité. Ainsi pour une variation de pH de 1, la concentration va varier de 10 ce qui explique la forte mortalité lors d’une variation de pH .)
Selon les poissons, il faut établir un certain pH dans l’aquarium et le garder stable au maximum. Cependant, le simple fait d’avoir de la vie dans l’aquarium modifie en permanence les paramètres chimiques. Il faut donc établir un aquarium avec un fort pouvoir tampon pour être tranquille.
Qu’est-ce que le pouvoir tampon ?
Pour les poissons, la plus grande cause de mortalité sont les variations de pH. Il faut donc s’assurer que le pH ne va pas varier brusquement. Pour cela, il faut agir sur deux fronts simultanément . Le pH et la dureté de l’eau pour obtenir un bon pouvoir tampon.
Le pouvoir tampon est la capacité d’une solution aqueuse à « encaisser » les changements brusques de pH.
Par exemple, dans une solution dont le tampon est bien établi et qu’il permet à cette solution de rester autour d’un pH de 7, je pourrais ajouter quelques gouttes d’acide pures sans que le pH ne change pour autant. Les variations de pH dues à la vie des poissons et des plantes sont tout de même légères donc nous n’avons pas besoin d’un pouvoir tampon excessif.
Lorsque l’on veut mesurer la dureté, on mesure la concentration en ions Calcium et Magnésium. Pourquoi ?
Car les ions carbonate et hydrogénocarbonate ne sont pas accessibles directement en solution. Ce n’est pas gênant car les ions calcium et magnésium sont les contres ions des hydrogénocarbonates et carbonates. Mais c’est pourtant bien ces derniers qui régissent la dureté de l’eau.
1 degré Français correspond à 4 mg de Calcium par litre d’eau ou 2 mg de Magnésium par litre d’eau.
Or lorsque l’on parle de l’ion carbonate ou hydrogénocarbonate il faut savoir qu’ils existent dans plusieurs couples acido-basiques.
Exemple de couple acido-basique :
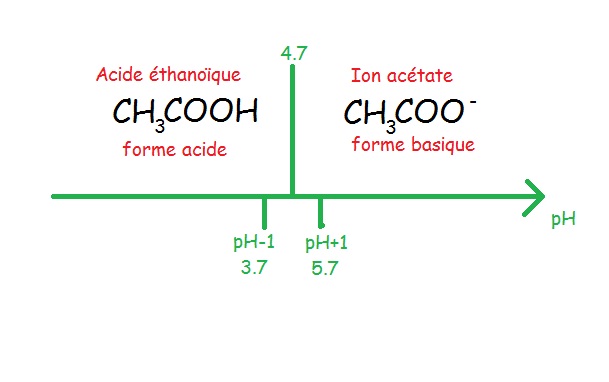
CH3COOH/CH3COO- (acide éthanoïque / ion acétate). Pour un pH compris entre 1 et 3.7, l’acide CH3COOH est majoritaire dans la solution et pour un pH> 5.7 la base qui est l’ion acétate est majoritaire.
En pratique, pour obtenir une solution tampon, il suffit de mélanger dans les mêmes quantités et concentrations, un acide et une base du même couple. Par exemple pour avoir 1L d’une solution tampon qui restera à pH=10, on va mélanger 0.5L d’une solution d’ion hydrogénocarbonate et 0.5L d’une solution d’ion carbonate. Ce litre de solution ne craindra pas des variations de pH.
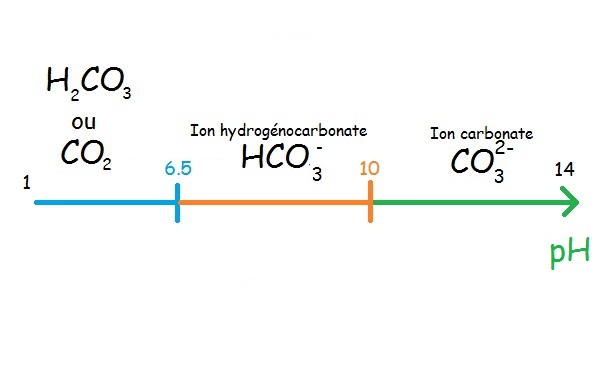
Il faut retenir qu’un ion à un domaine de pH où il est prédominant. Pour cela, on utilise une échelle, ce qui est plus lisible et clair. Voyons l’échelle de prédominance des couples qui nous intéresse en aquariophilie.
Les couples dioxyde de carbone / ion hydrogénocarbonate et ion hydrogénocarbonate / ion carbonate. Ici on dit que l’ion hydrogénocarbonate est un ampholyte car il est à la fois une base et un acide.
Ces couples nous intéressent car c’est eux qui génèrent la dureté de l’eau mais c’est aussi eux qui vont nous permettre d’établir un bon tampon pour le pH.
Pour les guppys par exemple il faut un pH=7.5, nous noyons donc que la solution doit se trouver dans la zone de prédominance de l’ion hydrogénocarbonate HCO3-. On utilisera alors le couple ion hydrogénocarbonate (acide) / ion carbonate (base) en le déstabilisant vers l’acide car ce couple s’équilibre sinon à un pH=10.
MAIS…il y en a un…l’ion hydrogénocarbonate fait aussi partie du couple dioxyde de carbone (acide) / ion hydrogénocarbonate (base) car c’est un ampholyte !
Vous comprenez donc que les poissons, qui respirent, rejettent du dioxyde de carbone et donc déstabilise l’équilibre…en ajoutant de l’acide carbonique (CO2, H2O) dans l’aquarium. Ce qui influe directement sur l’autre couple vu ci-dessus. Avec la respiration des poissons (entre autre) le pH peut varier c’est pour cela qu’il faut un tampon de pH.
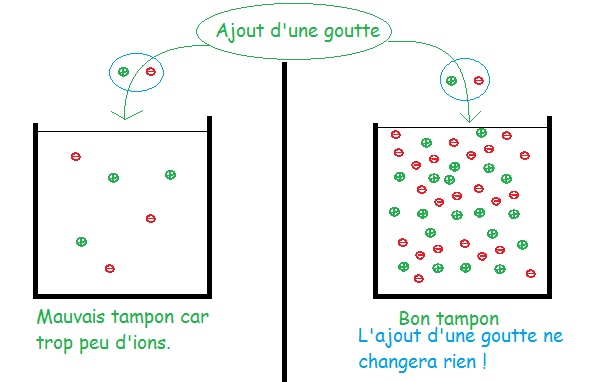
En pratique, l’eau du robinet n’est pas un bon tampon car elle ne contient que très peu d’ions. Il faut alors en ajouter pour établir un bon tampon autour du pH désiré. Il existe moult produit dans le commerce pour réaliser cela.
A gauche, une mauvaise solution tampon car il y a trop peu d’ions. L’ajout d’une goutte va tout changer ! On ajoute une goutte contenant deux ions alors qu’il y en a que 6. A droite, cela ne changera rien car il y a déjà beaucoup d’ions ! (Dans une vraie goutte, il y a plusieurs millions d’ions...)
CONCLUSION :
Le pH et la dureté de l’eau sont intimement liés par les ions hydrogénocarbonate et carbonate. C’est ainsi qu’il faut veiller à bien installer un bon tampon de pH avant d’introduire les poissons dans l’aquarium. Cela peut être frustrant de rester avec un aquarium vide pendant un mois mais c’est pourtant le temps nécessaire à l’établissement du microcosme et des équilibres chimiques. La chimie du vivant n’est qu’une affaire de patience. Mais le résultat en vaut la chandelle !